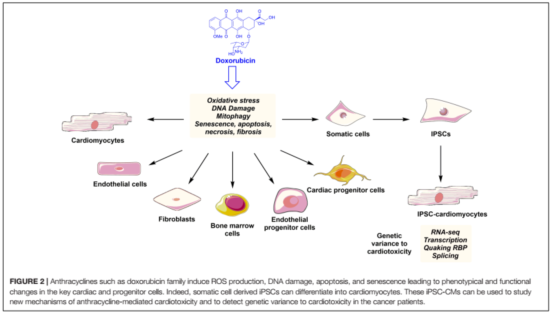
蒽環(huán)類藥物可以單獨(dú)應(yīng)用也可以與靶向藥物或者細(xì)胞毒藥物聯(lián)合應(yīng)用,是治療多種血液學(xué)和實(shí)體瘤最常用的抗腫瘤藥物。如阿霉素(doxorubicin, DOX)及其衍生物表柔比星被廣泛應(yīng)用于乳腺癌、子宮內(nèi)膜癌、胃癌、兒童實(shí)體瘤、軟組織肉瘤和侵襲性淋巴細(xì)胞或骨髓細(xì)胞白血病。使用蒽環(huán)類藥物與劑量有關(guān)(表1),蒽環(huán)類藥物導(dǎo)致的心臟毒性往往呈進(jìn)展性和不可逆性,特別是初次使用蒽環(huán)類藥物就可能造成心臟損傷,因此早期監(jiān)測和積極預(yù)防蒽環(huán)類藥物引起的心臟毒性顯得尤為重要。DOX可以對多種心臟細(xì)胞產(chǎn)生損傷(圖2),以下機(jī)制以心肌細(xì)胞為例。

?
?
1.蒽環(huán)類藥物心臟毒性的機(jī)理
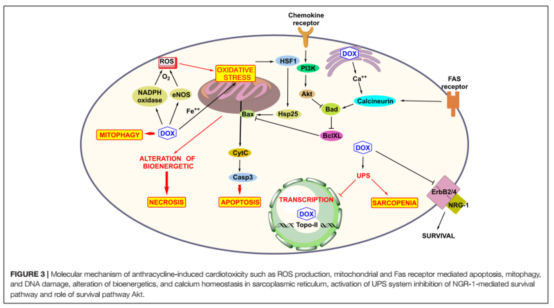
????????DOX介導(dǎo)的心臟毒性機(jī)制已被相當(dāng)清楚(圖3)。這一機(jī)制已經(jīng)被廣泛研究了50多年,包括(1)氧化應(yīng)激和生成活性氧;(2)拓?fù)洚悩?gòu)酶II的抑制和雙鏈DNA斷裂導(dǎo)致的轉(zhuǎn)錄基因改變與細(xì)胞凋亡;(3)線粒體功能損傷,從而激活細(xì)胞凋亡通路。此外心臟毒性還與高能磷酸鹽池的變化、腎上腺素能通路的異常相關(guān)。
1.1氧化應(yīng)激的作用
????????氧化應(yīng)激是DOX介導(dǎo)的心臟毒性研究最廣泛的機(jī)制。它源于活性氧(ROS)以及活性氮(RNS)產(chǎn)生的不平衡,和與其他器官相比心臟內(nèi)抗氧化劑相對較低水平的機(jī)制。線粒體ROX的產(chǎn)生主要是由于催化蒽環(huán)類氧化還原循環(huán)產(chǎn)生,DOX可以結(jié)合在內(nèi)皮細(xì)胞特異性的一氧化氮合成酶(eNOS)的還原酶區(qū)域,導(dǎo)致氧自由基和超氧化合物的增加,NO合成減少。當(dāng)線粒體內(nèi)阿霉素的濃度超過50-100μM, ROS水平開始明細(xì)增加。陽離子藥物DOX吸引了位于線粒體內(nèi)膜內(nèi)的一種負(fù)電荷磷脂——心磷脂。心磷脂參與氧化磷酸化過程,在線粒體依賴性凋亡通路中起重要作用。DOX與心磷脂形成不可逆復(fù)合物,也容易受到ROS的過氧攻擊。心磷脂過氧化導(dǎo)致(i)細(xì)胞色素c從線粒體膜分離,導(dǎo)致caspase依賴性凋亡,(ii)解開線粒體呼吸鏈復(fù)合體i、III和IV,形成線粒體滲透過渡孔(mPTP)。mPTP與Bcl-2家族蛋白相關(guān),導(dǎo)致使用ATP減少,與線粒體和細(xì)胞質(zhì)腫脹相關(guān),從而導(dǎo)致細(xì)胞壞死。急性阿霉素誘導(dǎo)心臟毒性時發(fā)生壞死。DOX介導(dǎo)的ROS激活熱休克因子(HSF)-1,增加熱休克蛋白(Hsp25)的表達(dá),使腫瘤抑制蛋白p53發(fā)生突變,從而改變Bcl-2和促凋亡Bax的水平。
???????鐵-DOX誘導(dǎo)ROS形成的氧化應(yīng)激起次要作用。阿霉素幾經(jīng)氧化還原過程,形成半醌代謝物或阿霉素醇,形成含鐵的化合物,導(dǎo)致 O2??和H2O2產(chǎn)生增加,誘導(dǎo)細(xì)胞凋亡。DOX介導(dǎo)的鐵在心肌細(xì)胞的積累比鐵-DOX復(fù)合物更有害。阿霉素調(diào)節(jié)ATP結(jié)合盒(ABC)B8蛋白(一種線粒體鐵輸出蛋白),導(dǎo)致蛋白減少,從而使得線粒體中輸出鐵的過程受阻。細(xì)胞內(nèi)鐵穩(wěn)態(tài)是由鐵反應(yīng)元件(IREs)和鐵調(diào)節(jié)蛋白(IRPs)來平衡的。高鐵細(xì)胞水平促進(jìn)[4Fe-4S]簇的組裝,誘導(dǎo)IRPs的活性,并消除其與IRE的結(jié)合。阿霉素或其代謝物從[4Fe-4S]簇中去除Fe2(+)的表達(dá),從而增強(qiáng)其鐵攝取蛋白質(zhì)、轉(zhuǎn)鐵蛋白mRNA的穩(wěn)定性,并阻止鐵螯合蛋白、鐵蛋白的翻譯。因此,DOX通過改變蛋白質(zhì)的運(yùn)輸促進(jìn)細(xì)胞內(nèi)鐵的積累和減少鐵的亞細(xì)胞細(xì)胞器釋放,導(dǎo)致細(xì)胞內(nèi)鐵過載。
?
1.2 其他相關(guān)機(jī)制
????????DOX可以抑制拓?fù)洚悩?gòu)酶2 (Top2),通過形成一個共價的Top2 -DOX-DNA復(fù)合物(裂解復(fù)合體),導(dǎo)致雙鏈DNA斷裂。Top2由同功酶Top2α和Top2β。在G2/M期Top2α高度表達(dá)在增殖(惡性和非惡性)細(xì)胞。它是染色體分離的必要條件。DOX化療顯示出很高的療效,因?yàn)門op2α在癌細(xì)胞是上調(diào)表達(dá)的。然而,在成年人的靜止心肌細(xì)胞Top2β尤為豐富且不斷表達(dá)。阿霉素通過Top2β插入心肌細(xì)胞DNA并產(chǎn)生毒性。DOX可以促進(jìn)心肌細(xì)胞有絲分裂,使得心肌細(xì)胞線粒體通透性增加,心肌細(xì)胞急性損傷,引起細(xì)胞壞死。DOX促進(jìn)免疫細(xì)胞如NK細(xì)胞、T細(xì)胞、巨噬細(xì)胞的分化,死亡相關(guān)受體蛋白的表達(dá)增加,誘導(dǎo)細(xì)胞凋亡。
?
?
?
?
2. 蒽環(huán)類藥物介導(dǎo)的心臟毒性監(jiān)測標(biāo)記物
?
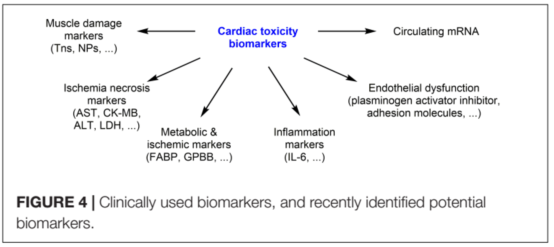
???????評估和監(jiān)測抗癌藥物誘導(dǎo)心臟毒性主要的心臟生物標(biāo)志物是利鈉肽(NPs)
和肌鈣蛋白(Tns)。Tns是心臟損傷的標(biāo)志,而NPs是體積擴(kuò)大和心室增大的壓力標(biāo)志。最近有研究發(fā)現(xiàn)潛在的生物標(biāo)志物(圖4)。炎癥相關(guān)標(biāo)志物(高敏c反應(yīng)蛋白、白介素-6)、內(nèi)皮功能障礙(纖溶酶原激活抑制劑、可溶性細(xì)胞間粘附分子)、心肌缺血(脂肪酸結(jié)合蛋白、糖原磷酸化酶)和NRG-1等生物標(biāo)志物也被認(rèn)為是心臟毒性的診斷標(biāo)志物。一些心臟miRNA(如。miR-208、miR-1和miR-133)也與DOX心臟毒性有關(guān),但這些數(shù)據(jù)需要進(jìn)一步驗(yàn)證。也有報(bào)道在蒽環(huán)類化療后,心肌缺血/壞死相關(guān)標(biāo)志物水平升高如血清心肌酶[aspartateaminotransferase (AST),肌酐激酶(CK-MB),乳酸脫氫酶(LDH),丙氨酸轉(zhuǎn)氨酶(ALT)]。
?
?
?
3.降低蒽環(huán)類藥物心臟毒性的策略
?
3.1 研發(fā)新的蒽環(huán)類藥物
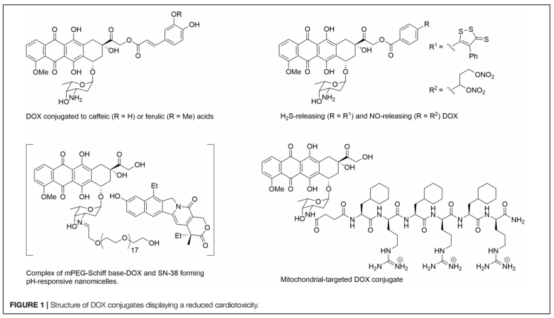
????????近年來,研究集中在開發(fā)新的DOX結(jié)構(gòu)藥物,以減少心臟毒性,而不改變其對癌細(xì)胞的細(xì)胞毒性效力。為了延長循環(huán)水平和控制DOX的釋放,已經(jīng)引入了脂質(zhì)體DOX 。聚乙二醇脂質(zhì)體 DOX (PEG-DOX)被發(fā)現(xiàn)具有非常長的循環(huán)時間,但它對皮膚有很高的親和力。非peg脂質(zhì)體DOX (MyocetT)也得到了開發(fā)。MyocetT與表柔比星(表1)具有相似的心臟毒性。另一種降低DOX介導(dǎo)的心臟毒性的方法是使用具有心血管保護(hù)作用的藥物(圖1)。例如,與DOX相比,將DOX與咖啡因和阿魏酸等抗氧化劑結(jié)合可以降低毒性。或NO供體(NitDOX)可釋放硫醇和NO,降低體內(nèi)心臟毒性。另一種方法是將DOX與改變藥物藥理分布的載體結(jié)合,從而降低藥物在心臟中的水平,并將DOX靶向傳遞到腫瘤細(xì)胞。由mPEG-Schiff base-DOX和7-乙基-10-羥基喜樹堿(SN-38)組成的納米粒,不僅可以根除乳腺癌干細(xì)胞,而且可以提高腫瘤部位的藥物積累效率,副作用更小,對心臟、肝臟、脾臟、肺、腎沒有明顯的毒性。將DOX與線粒體穿透肽結(jié)合產(chǎn)生一種稱為線粒體靶向DOX(線粒體靶向DOX, MtDOX)的化合物,該化合物可以通過激活線粒體代償性生物發(fā)生,而使心肌細(xì)胞從線粒體損傷中恢復(fù),而不會引起與心臟毒性有關(guān)的核損傷。雖然MtDOX在藥物敏感細(xì)胞中細(xì)胞毒性較小,但在耐阿霉素細(xì)胞中表現(xiàn)出較強(qiáng)的細(xì)胞毒性作用。
?
?
?
3.2 預(yù)防蒽環(huán)類致心臟毒性藥物
????????地塞米松,血管緊張素轉(zhuǎn)換酶(ACE)抑制劑,β-受體阻滯劑已經(jīng)被提議作為預(yù)防策略,目前尚無足夠臨床依據(jù)證明療效。鐵螯合劑如右旋拉唑烷已經(jīng)被證明可以與人類Top2α和Top2β的atp酶結(jié)構(gòu)域結(jié)合,防止蒽環(huán)類Top2綁定,從而預(yù)防蒽環(huán)類藥物心臟毒性。右旋拉唑烷的一個重要缺點(diǎn)是具有致癌潛能,發(fā)展為急性髓系白血病和骨髓增生異常綜合征風(fēng)險(xiǎn)增加。因此在歐洲,它的使用在兒童是禁忌的,歐洲藥品管理局(EMA)和FDA僅限于晚期或轉(zhuǎn)移的成人患者。目前,新型的心臟保護(hù)藥物對保護(hù)和治療心臟毒性有極大的興趣。例如褪黑激素的拮抗劑和大麻素CB1受體具有對抗阿霉素誘導(dǎo)的心臟毒性。紅細(xì)胞生成素也有心血管保護(hù)作用,抗蒽環(huán)介導(dǎo)的心臟毒性作用。
?
?
?
作者:中山大學(xué)附屬第七醫(yī)院腫瘤科朱夢媛



